Sel Elektrokimia : SEl VOLTA / SEL GALVANI (1 of 2)
On Friday, October 16, 2015
Elektrokimia berasal dari kata Elektro
(listrik) dan Kimia (zat kimia) yaitu proses menghasilkan listrik karena
adanya reaksi kimia (dari energi listrik menjadi energi kimia atau energi kimia
menjadi energi listrik. Sel Elektrokimia dibagi menjadi 2 yaitu :
"Electrochemical derived from phrase Electro and Chemical that means process to generate electricity due to chemical reaction (from electrical energy to chemical energy or reverse). Electrochemical cells are divided into 2 such as :"
"Electrochemical derived from phrase Electro and Chemical that means process to generate electricity due to chemical reaction (from electrical energy to chemical energy or reverse). Electrochemical cells are divided into 2 such as :"
- Sel Elektrolisis
- Sel Volta / Sel Galvani
Perbandingan Sistem "Sel
Galvani / Sel Volta dengan Sel Elektrolisis"
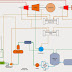
Gambar Sel Volta dengan Sekat
Berpori
Sumber : Stephen Lower
"Electrochemistry".Simon Fraser University
Gambar Sel
Volta dengan Jembatan Garam
DERET VOLTA :
Istilah - Istilah Pada Sel Volta :
- ERed (Potensial Reduksi) : harga nilai tegangan setengah reaksi kimia yang cenderung menerima elektron, karena ERed semakin besar maka kemampuan reduksi besar dan sulit untuk oksidasi
- EOks (Potensial Oksidasi) : harga nilai tegangan setengah reaksi kimia yang cenderung melepas elektron, karena EOks semakin besar menunjukkan ERed semakin kecil sehingga kemampuan oksidasinya besar dan sulit untuk reduksi
- EElektroda : harga nilai tegangan setengah reaksi kimia baik ERed atau EOks, namun untuk penyebutan lebih cenderung ke ERed (nilai pada Deret Volta keseluruhannya menggunakan ERed) walau itu menunjukkan EElektroda maupun EOks (EOks jika diubah ke ERed maka akan berkebalikan tanda yang semula EOks (+) menjadi ERed (-)
- ESel : selisih antara nilai ERed - EOks (ESel = ERed - EOks atau ESel = EBesar - EKecil), harga nilai tegangan satu reaksi kimia
Komponen yang Terdapat di Sel Volta :
- Anoda (-) : elektroda tempat berlangsungnya proses Oksidasi
- Katoda (+) : elektroda tempat berlangsungnya proses Reduksi
- Elektrolit : larutan pengisi 2 sel volta yang masih mengandung ion logam elektrodenya, misalnya elektroda Cu menggunakan elektrolit CuSO4 dan elektroda Zn menggunakan elektrolit ZnSO4
- Kawat Penghubung : tempat mengalirkan elektron dari Anoda (-) ke Katoda (+)
- Jembatan Garam : penghubung antara kedua elektroda, berupa garam konsentrat atau elektrolit gel yang fungsinya menjaga keseimbangan ion elektrolit. Syarat garamnya harus tidak bereaksi dengan elektrolit dan konsentrasinya lebih tinggi dari elektrolit sehingga ion bisa berpindah ke elektrolit yang kekurangan ion. Garam - garamnya seperti NaCl, KCl, KNO3, NaNO3. Bentuk jembatan garam ada yang berupa Sekat Berpori atau Kanal U, misalnya seperti gambar diatas larutan ZnSO4 terjadi kenaikan Zn2+ dan dalam larutan CuSO4 terjadi penurunan Cu2+ dan jumlah elektron antara keduanya harus sama untuk keseimbangan reaksi redoks sehingga muatan negatif dari garam (NO3-) masuk ke larutan ZnSO4 bertukar dengan Zn2+ yang kelebihan untuk menyetarakan keseimbangan muatan positif Zn2+ yang terus naik dan pada larutan CuSO4 terjadi penurunan Cu2+ (kelebihan ion) sehingga ion positif garam (Na+) masuk ke larutan CuSO4 dan ion negatif larutan (SO42-) masuk ke jembatan garam menggantikan ion negatif garam (NO3-) yang hilang.
- "Salt bridge : connect agent between two electrodes, concentrate salt or gel electrolyte have function to keep balance of electrolyte ions. Terms salt must not react with electrolyte and concentration higher from electrolyte so ions can move to electrolyte that dificiency ions. That salts likes NaCl, KCl, KNO3, NaNO3. The form salt bridge is porous membrane or U canal, the example like above picture ZnSO4 solution occur raising Zn2+ and CuSO4 solution occur decreasing Cu2+ and the number electron between both must similar for balacing redox reaction so negative charge from salt (NO3-) entering into ZnSO4 solution and switch with Zn2+ that excess to equalize balancing positive Zn2+that continue raising and CuSO4 solution occur decreasing Cu2+ (excess ion) so that salt positive ion (Na+) entering into CuSO4 solution and negative ion (SO42-) entering into salt bridge replace removed negative salt ion (NO3-)."
- Voltmeter : pengukur adanya tegangan listrik
Prinsip Penulisan Sel Volta :
- Notasi Sel : Oksidasi // Reduksi, contoh : Zn / Zn2+ // Cu2+ / Cu
- Nilai Potensial Sel (ESel ) = ERed - EOks
Contoh Reaksi Spontan atau Tidak Spontan :
- Reaksi diatas dapat berlangsung SPONTAN, karena logam yang mengalami reduksi (Cu) mempunyai ERed yang lebih besar dari Zn (bisa dilihat di Deret Volta bahwa Cu terletak disebelah kanan Zn)
- Reaksi diatas TIDAK SPONTAN, karena logam yang mengalami reduksi (Zn) nilai ERed lebih kecil daripada ERed Cu (bisa dilihat di Deret Volta bahwa Zn terletak disebelah kiri Cu)
BACA JUGA : Macam - Macam Demineralization Plant / Water Treatment Plant / Ion Exchange Plant
Macam - Macam Sel Volta :
- Sel Kering Tidak Dapat Di Charge (Baterai Primer)
Terdiri dari :
- Katoda (+) dari Carbon (C)
- Anoda (-) dari Zinc (Zn)
- Elektrolit dari pasta Batu Kawi (MnO2), serbuk karbon (C), Salmiak (NH4Cl) dan ZnCl2
- Reaksi :
Katoda (+) : 2 MnO2 + 2 NH+ + 2e
---> Mn2O3 + H2O + 2 NH3
Anoda (-) : Zn ---> Zn2+ + 2e
Reaksi menjadi : 2 MnO2 + 2 NH+
+ Zn ---> Mn2O3 + H2O + 2 NH3 +
Zn2+
2 MnO2 + 2 NH+
+ Zn ---> Mn2O3 + H2O + [Zn(NH3)4]2+
- Sel Kering Dapat Di Charge / (Baterai Nickel - Cadmium / Baterai Sekunder)
- Katoda (+) dari Nikel (Ni)
- Anoda (-) dari Cadmium (Cd)
- Elektrolit dari KOH
- Reaksi :
Katoda (+) : NiO + 2 H2O + 2e --->
Ni(OH)2 + 2 OH-
Anoda (-) : Cd + 2 OH- ---> Cd(OH)2 + 2e
Reaksi menjadi : NiO + 2 H2O + Cd
---> Ni(OH)2 + Cd(OH)2
- Baterai Alkaline (Baterai Lebih Awet 2x Daripada Baterai Biasa)
Terdiri dari :
- Katoda (+) dari MnO2
- Anoda (-) dari Zinc (Zn)
- Elektrolit dari KOH (alkali)
- Reaksi :
Katoda (+) : 2 MnO2 + 2 H2O + 2e
---> 2 MnO(OH) + 2 OH-
Anoda (-) : Zn + 2 OH- ---> Zn(OH)2
+ 2e
Reaksi menjadi : 2 MnO2 + 2 H2O
+ Zn2+ ---> 2 Mn)(OH) + Zn(OH)2
- Sel Basah (Aki)
- Katoda (+) dari PbO2
- Anoda (-) dari Timbal (Pb)
- Elektrolit dari H2SO4
- Reaksi Penggunaan Aki :
Katoda (+) : PbO2 + SO42- +
4 H+ + 2e ---> PbSO4 + 2 H2O
Anoda (-) : Pb + SO42-
---> PbSO4 + 2e
Reaksi menjadi : PbO2 + 2 SO42-
+ 4 H+ + Pb ---> 2 PbSO4 + 2 H2O
5. Reaksi
Pengisian Ulang Aki (Setrum Aki) :
2 PbSO4 + 2 H2O ---> Pb + 2
SO42- + PbO2 + 4 H+
Referensi :
[1]http://2012books.lardbucket.org/pdfs/principles-of-general-chemistry-v1.0/s23-electrochemistry.pdf
[2] Chafter 19 from the Book Principles of General Chemistry "Electrochemistry"
ARTIKEL TERKAIT :
1. Sel Elektrokimia : SEL ELEKTROLISIS (2 of 2)
2. Istilah Mirip tapi Tidak Sama Artinya di Teknik Kimia (1 of 2)
3. Asset Wellness "Thermography" Boiler CFB dan Turbine PLTU
[1]http://2012books.lardbucket.org/pdfs/principles-of-general-chemistry-v1.0/s23-electrochemistry.pdf
[2] Chafter 19 from the Book Principles of General Chemistry "Electrochemistry"
ARTIKEL TERKAIT :
1. Sel Elektrokimia : SEL ELEKTROLISIS (2 of 2)
2. Istilah Mirip tapi Tidak Sama Artinya di Teknik Kimia (1 of 2)
3. Asset Wellness "Thermography" Boiler CFB dan Turbine PLTU