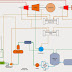
Pemurnian Uap (Steam) dari Panas Bumi
On Sunday, March 17, 2019
Panas bumi dihasilkan oleh magma gunung berapi terletak dibawah batuan yang keras sehingga bertekanan cukup tinggi. Panas bumi sebagai heat exchanger merupakan energi terbarukan yang bisa digunakan untuk menggerakkan turbine karena menghasilkan uap murni.
Uap yang berasal dari perut bumi masih mengandung berbagai macam senyawa kimia dan kelembaban air yang bisa berbahaya di blade turbine. Senyawa yang terkandung seperti carbon dioxide (CO2), methane (CH4), hydrogen suphide (H2S) dan ammonia (NH3). Diperlukan treatment khusus terhadap panas bumi dengan cara melakukan purifikasi atau separasi, berikut cara-cara yang bisa dilakukan :
- Metana (CH4)
Terbentuk sebagai reaksi kimia sedimen bahan organik dan umumnya tidak berbahaya untuk pernafasan jika diruang terbuka dan tidak berbahaya terhadap material. Keberadaan metana dalam ruang terbatas (confined space) bisa mengusir keberadaan oksigen sehingga bisa menyebabkan asma dan gangguan peredaran darah.
Metana dapat diminimalisir menggunakan beberapa cara seperti :
- Sistem aerasi dengan melewatkan udara ke air kemudian dihembuskan ke atmosfer
- Adsorpsi dengan activated carbon
- Pada temperature steam 800-880 oC & tekanan 20-30 atm, metana akan bereaksi dengan H2O membentuk hydrogen (H2) dan carbon-monoxide (CO) dan umumnya dibantu katalis nikel, atau alumina. Reaksinya adalah : CH4 + H2O ---> 3 H2 + CO
- Carbon Dioksida (CO2)
Kehadiran senyawa ini bisa memicu terbentuknya bicarbonate yang bersifat asam sehingga permukaan tube mudah ter-abrasi dan cepat terjadi korosi.
Gas CO2 bisa diminimalisir dengan melakukan beberapa hal sebagai berikut :
- Jika yang terbentuk adalah asam lemah bicarbonate H2CO3 jika dikontakkan dengan air maka cara efektof cukup direaksikan dengan larutan basa
- Diserap dengan solid adsorbent seperti aluminosilicate, zeolite, porous alumina, silica gel, silica alumina
- Dipisahkan dengan membrane permeable
- Asam Sulfida (H2S)
Pada kondisi aerob dan moisture content tinggi calcium di batuan kapur (CaCO3) berinteraksi dengan sulphur di pyrite (FeS2) untuk membentuk gypsum (CaSO4), sesuai reaksi : 8 CaCO3 + 4 FeS2 + 7 O2 --->
8 CaSO4 + 2 Fe2O5 + 8 CO2. Ketika lingkungan berubah anaerob maka sulphate direduksi menjadi hydrogen sulphide (H2S).
Hydrogen sulphide dapat diminimalisir dengan beberapa hal sebagai berikut :
- Oksidasi oleh chlorine, sesuai reaksi : 4 Cl2 + S2- + 4 H2O ---> 8 H+ + 8 Cl- + SO42-. Faktor yang mempengaruhi adalah pH, temperatur, waktu, konsentrasi dan flow rate. Untuk lebih efektifnya oksidasi oleh chlorine ditambahkan physical filtration (manganese greensand filter)
- Oksidasi oleh hydogen peroxide (H2O2), sesuai reaksi sebagai berikut : H2O2 + H2S ---> S + 2 H2O pada pH < 8.5 dan 4 H2O2 + S2- ---> SO42- + 2 H2O pada pH > 8.5
- Aeration, teknik yang digunakan mirip peralatan scrubber yaitu spray water sehingga H2S akan tertangkap oleh air dan bereaksi membentuk sulphite. Kondisi yang dibutuhkan oleh sistem aeration adalah pH asam, waktu kontak lama dan energi input yang besar (pompa atau fan) sedangkan pada kondisi pH basa kurang efektif. Cara ini cocok untuk kadar H2S < 2 ppm
- Ion exchange & Reverse-Osmosis, proses ini cukup rumit dan kurang efektif
- Ozonation, teknik paling efektif dari semuanya namun biaya operasional sangat mahal. Sistem yang digunakan adalah dengan menggunakan daya listrik di elektrode dan menggunakan udara lingkungan atau oksigen murni sebagai sumber oksigennya
- Chemical treatment, menggunakan kalium permanganat untuk mengikat asam sulfida, sesuai reaksi : 2 KMnO4 + 3 H2S ---> 3 S + 2 MnO2 + 2 H2O + 2 KOH ---> terjadi pada pH <7.5. Aplikasi ini jarang digunakan karena menghasilkan produk samping berupa endapan sehingga penggunaan umumnya disertai sand filter (manganese greensand filter)
- Catlytic carbon, sistem ini menggunakan sistem adsorpsi dimana kemampuannya yang cukup kecil hanya <0.3 ppm dan cepat jenuh. Ketika carbon sudah jenuh maka sistem penyerapan asam sulfida kurang efektif dan harus diganti
Manfaat produk yang dihasilkan adalah atom S bukan senyawa sulphate (SO42-) adalah :
- Proses lebih cepat
- Sludge yang diproduksi sedikit
- Tidak ada sulphate maupun tio-sulphate yang dihasilkan
- Produk berupa sulphur (S) bisa digunakan untuk produksi H2SO4 dan bio-bleaching
- Tidak membutuhkan oksigen
- Hemat energi
- Ammonia (NH3)
Ammonia mendidih pada suhu 33.34 oC dan storage harus pada tekanan dan temperatur rendah. Umumnya ammonia dijual dan ditransportasikan dalam bentuk ammonia liquor or pressurized or refrigerated anhydrous liquid ammonia sehingga sering dijumpai transportasi ammonia dengan membawa refrigerant dalam truk.
- Gas Decomposition Method, gas ammonia terdekomposisi menjadi H2 dan N2 dengan penambahan metal catalyst (bukan nobel metal) dan kemudian lanjut menjadi H2O dan N2 oleh elektrolit ion. Sistem ini ramah lingkungan karena tidak menghasilkan CO2 dan NOx.
- Scrubber Method, mengkontakkan ammonia dengan larutan asam seperti H2SO4 seperti reaksi berikut : NH3 + H2SO4 ---> (NH4)2SO4 dan produk ammonium sulphate tersebut adalah pupuk yang umum digunakan untuk tanaman.
- Burning Method, gas ammonia dibakar menggunakan gas LNG sehingga dihasilkan gas CO2 dan NOx dan kurang ramah lingkungan karena gas buangnya bisa menyebabkan hujan asam
- Catalyst Decomposition Method, gas ammonia dicampur dengan udara kemudian dan terurai karena pemanasan dengan ditambahkan katalis nobel metal
Kutip Artikel ini sebagai Referensi (Citation):
Feriyanto, Y.E. (2019). Pemurnian Uap (Steam) dari Panas Bumi, Best Practice Experience in Power Plant. www.caesarvery.com. Surabaya
Referensi:
[1] Feriyanto, YE. (2018). Hubungan Chlorine dengan Chloride. Mengenal Lebih Dalam Teknik Kimia dan Manajemen Teknologi, Surabaya
[2] Bakey, Kevin. (2015). The Production of Hydrogen Gas : Steam Methane Reforming
[3] Ficicilar, Berker. (2004). Carbon Dioxide Removal in Steam Reforming. The Department of Chemical Engineering
[4] Feriyanto, YE. (2015). Steam & Condensate System PLTU 200 MW. Mengenal Lebih Dalam Teknik Kimia dan Manajemen Teknologi, Surabaya
[5] Edward, S., Alharthy, R., dan ghaly, A. (2011). Removal of Hydrogen Sulphide from Water. Americal Journal of Environmental Sciences
[6] Lemley, A., Scwartz, J., dan Wagenet, L. (1999). Hydrogen Sulphide in Household Dringking Water. Cornell Cooperative Extension
[7] Majima, M., Hiraiwa, C., dan Yamaguchi, A. (2012). Development of Ammonia Gas Removal Device. Journal of Environment, Energy & Resources
Ingin Konsultasi dengan Tim Expert Website, Silakan Hubungi KLIK